近20年来,主动脉腔内修复技术(EVAR)发展迅猛,应用范围越来越广,其中具有里程碑意义的技术创新包括:1991年Parodi医生报道肾下腹主动脉瘤的腔内修复;1994年Yusuf医生报道破裂性腹主动脉瘤的腔内修复;同年,Dake医生报道胸主动脉瘤的腔内修复;1996年Park医生报道开窗支架进行腹主动脉瘤的腔内修复;1997年Inoue医生报......
郭伟 张宏鹏 解放军总医院血管外科
近20年来,主动脉腔内修复技术(EVAR)发展迅猛,应用范围越来越广,其中具有里程碑意义的技术创新包括:1991年Parodi医生报道肾下腹主动脉瘤的腔内修复;1994年Yusuf医生报道破裂性腹主动脉瘤的腔内修复;同年,Dake医生报道胸主动脉瘤的腔内修复;1996年Park医生报道开窗支架进行腹主动脉瘤的腔内修复;1997年Inoue医生报道分支支架进行胸腹主动脉瘤的腔内修复;1999年Inoue医生报道分支支架进行主动脉弓部的腔内修复;2001年Stanley医生报道开窗支架进行胸腹主动脉瘤的腔内修复;同年,Chuter医生报道多分支支架同时治疗累及4支内脏动脉的胸腹主动脉瘤。从以上这些标志性的“事件”中我们可以看到,支架型血管如何“跨越”主动脉分支是主动脉腔内治疗技术的难点,而且在未来的一段时间内仍无法完美解决。目前处理主动脉分支血管的热点技术主要包括:完全腔内技术和杂交技术。
热点技术之一:杂交技术的运用
对于胸腹主动脉瘤而言,相比传统外科技术,杂交技术的优势仍是“微创”:无需胸腹联合切口,内脏缺血时间短,但最重要的是不需要进行主动脉高位阻断,对于合并心肺功能不全的患者,高位阻断几乎是致命性的。另外对于既往有开胸行主动脉外科手术病史的患者,此术式因可避免二次开胸,几乎是该类患者的唯一选择。然而杂交技术并没有避免巨大手术切口、没有避免多个内脏血管的旁路术、没有避免对肋间动脉和腰动脉的破坏,而且多枚移植物长距离地覆盖主动脉,其远期稳定性尚不明确。血管重建方法主要包括顺行和逆行内脏动脉旁路术(图1)。顺行旁路完成后血流方向不变,但应用范围有限。逆行旁路完成后血流自下而上,几乎适用于所有的病变类型,但要注意避免选择单侧髂动脉为所有内脏动脉供血。
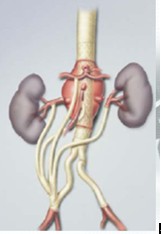
图1. 杂交手术:逆行内脏动脉旁路+EVAR
对于主动脉弓部动脉瘤,杂交手术的方式将更多样。根据支架型血管需要覆盖的范围,可以选择经胸升主动脉-头臂动脉旁路的胸-胸杂交,或者经颈—颈—锁骨下旁路的颈胸杂交手术(图2)等等。术前需要进行全脑血管造影,了解颅内血管交通情况,评价脑缺血耐受时间。
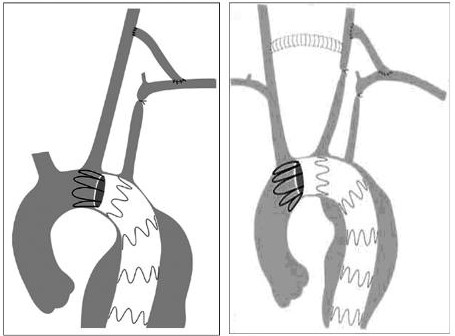
图2 颈胸杂交手术+EVAR
杂交手术在旁路手术完成后可以同期或分期进行腔内修复术。同期手术避免了二次麻醉和手术切口,缺点是造影剂会加重肾功能的损伤,且要求拥有杂交手术室条件,目前国内多数医院尚不具备。
热点技术之二:完全腔内技术重建主动脉分支血管
开窗及多分支支架(图3)扩展了主动脉腔内修复的适应征。术前根据高质量的影像学资料和精确的测量,设计合适的支架。通过这些器材实现完全腔内技术重建主动脉分支血管的目的。该技术成功率高、死亡率低,早期结果满意。
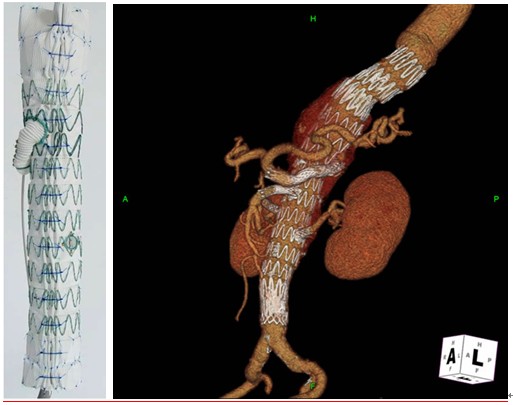
图3开窗及多分支支架
新的器械就会面临新的问题,多篇文献报道术后内脏血管的闭塞,其他常见的并发症包括:支架型血管无法打开,支架断裂,各种类型的内漏,支架移位等。分支支架由于是由多部分组成的,每部分受到压力不同,而且主动脉及分支动脉随心动周期搏动的幅度不同,这些均可能造成支架的移位。另外,支架的起始端及远端与动脉壁接触的位置会出现搏动不一致的情况,长时间以后可能出现支架断裂和血管内膜增生,从而引起动脉的闭塞,进而出现无法挽救的灾难性事件。未来的支架改进需要更多地考虑如何使得支架在主动脉这样一个不断搏动的环境中能够保持稳定。因此,“开窗”或“多分支”支架型血管并不能适合所有解剖的病变。有关问题仍需要深入研究。
很多专家认为杂交技术是一种处于过渡阶段的手术方式,不久将被更微创的开窗及分支支架技术所取代。但是对于解剖形态复杂的病变,杂交技术仍将在很长时期内具有重要应用价值。



 京公网安备 11010502033353号
京公网安备 11010502033353号